
| ||||||||

|
||||||||

|
||||||||

|
||||||||

|
||||||||

|
||||||||

|
||||||||

|
||||||||

|
||||||||
| 一方、細胞膜の糖蛋白質の例としては、村松らによれば(20)、KL-2の細胞培養系で次のような事実が明らかにされている。それによると、細胞濃度が上がって増殖が止まったときにはCore部分のマンノースは3モル結合し、しかもその後に末端の糖鎖が結合しているのに対し、増殖中の時にはCore部分のマンノースが3モル以上になり、しかも末端部分が未完成であるらしい。 | ||||||||
| このようにみてくると、それが細胞外であろうと細胞内であろうと、その糖鎖のheterogeneityは本質的に同じような問題を抱えていることが予想される。それではこのような糖鎖の不揃いは一体何に依存しているのであろうか。細胞の状態や環境、そしてまた遺伝的に支配されているともいわれる。しかしそれはともかくとして間違いのないことは、あくまでもこれらの糖蛋白質は生合成されたものとして、生合成の過程を確実に反映しているということであろう。 | ||||||||
| II−2.糖蛋白質生合成の問題点 | ||||||||
| 糖蛋白質生合成のひとつの大きな問題は、蛋白質中のアミノ酸残基に最初の糖(たとえばN-アセチルグルコサミン)をどの細胞内顆粒添加するか、粗面小胞体かあるいは滑面小胞体かとの問題である。このことはアミノ酸残基への糖転移をどう理解するかとのことで重要ではあるが、ここでは一応糖鎖全体の生合成をTransportに焦点をあてて研究が進められてきたγ-Globulinを取り上げてみたい。Kern, Swensonらは(21)γ-Globulinのみを産生分泌しているリンパ節細胞を用い、3H-グルコサミン、3H-ガラクトースと保温し、細胞内外に存在するγ-Globulinの糖鎖に入った放射能を測定してみると、最初に細胞内に現れ、少しの時間をおいて細胞外に出てくることを示した。しかし3H-グルコースで標識し、細胞内外のγ-Globulinの糖鎖のうちシアル酸のみを測定してみると、細胞内へのシアル酸をもったγ-Globulinの出現は、それの細胞外への出現と全く同時である(図4、5)。このことはシアル酸以外の糖添加反応は細胞内での動きに対応し、シアル酸添加は細胞膜から外への放出反応に関係していると考えられる。ここでいう細胞内の動きとは、蛋白合成場所から細胞膜までの輸送か、あるいは蛋白合成場所からある程度完成された塔蛋白質をプールする細胞内小胞体までの輸送を表すと考えてよいように思う。ここで重要な点は、このような糖転移反応を介して起こる細胞内外での動きを何によって保証しうるかについての考察である。この点を糖転移反応という枠の中で解明することができないだろうか? | ||||||||
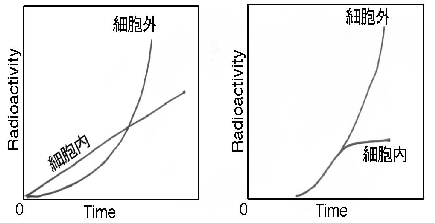
|
||||||||
|
左は図4で3H-グルコサミン標識、右は図5で、3H-グルコース標識でシアル酸 のみ測定 |
||||||||
| Eylarは細胞外へ分泌される蛋白質の内明らかにgranuleによって細胞内を輸送されるもの以外は、糖という切符をもらって輸送されるという概念を提出した。この考え方は、生理活性としては血液型物質以外明確にならなかった糖の問題を細胞内から細胞外への蛋白質の輸送という問題の中に具体化したものとして高く評価されるべき問題提起であった。しかしながら、その後これを指示する積極的データは得られていないし、またそのような実験は行われていないように見える。このことは糖の問題を目印というふうに静的に、しかも別個に存在する認識機構という問題にすり替えたところに、この把握の仕方が実践性を失った根拠が潜んでいるように見える。それ故に、この糖部分をより実践的に把握するためには、糖は目印でありながらも、なおその反応過程は高分子物質を移動させるというエネルギー要求系の中にあることを考え、そこに糖ヌクレオチドからの糖転移反応を対象化することだと思われる。 | ||||||||
| II−3.糖供与体としての糖ヌクレオチド転移反応の問題点 | ||||||||
| 約20年前アルゼンチンのLeloirが(22)UDP-グルコースをイースト菌のガラクトース代謝の研究中に発見して以来100種類以上の糖ヌクレオチドが発見同定され、またその大部分は糖部分の構造変換、または糖転移の中間体として説明が付けられてきた(12)。確かに多くの生体から抽出精製された系において糖残基の転移によって新たな共有結合が形成されることは明らかにされてはいるが、その反応のstoic hiometryは高度に精製された酵素か、また顆粒状の酵素の場合には、糖転移活性を犠牲にして、阻害剤によって分解酵素系を抑えることによってはじめて測定することが可能である。このことは言い換えるならば、より生体に近いような存在状態においては、この反応のstoichiometryは不明であるといってよい。 | ||||||||
| UDP-sugar + Acceptor → UDP + Acceptor-sugar ??? | ||||||||
| 上に例としてUDP-sugarをあげたが、これがGDP-sugarであろうと同じであり、特に物質輸送のひとつの過程でもある肝細胞の小胞体のように多くの酵素がひとつの系を構成するところでは全く不明といってよい(なお、ここではsugar-1-phosphateを転移するような系については言及しない)。このことは何故一般の糖ヌクレオチドはリン酸2モルによって活性化されているのかということを不問に付さざるを得ず、シアル酸のようなケト酸の活性化が何故CMP-シアル酸という形態をとるのかをも解明の対象からはずしてしまっている。このような問題を解くことが糖ヌクレオチドの全体性を解明することであり、物質輸送の中で糖ヌクレオチドを位置づけることでもある。 | ||||||||
| II−4.糖蛋白質の構造、生合成そして輸送の統一的把握としての”距離”概念の導入 | ||||||||
| これまで述べてきたように糖蛋白質の構造、生合成および輸送を考えるには多くの問題点を克服しなければならない。しかしながら前述したように、物質輸送を生物現象がもつ一般性、すなわち方向性、効率そして調節ということの中で捉えるとすれば、ひとつの考え方としてエネルギー要求系、つまり高度に組織化された系であることが要求されるであろう。 | ||||||||
| 一方糖ヌクレオチドからの糖残基の転移反応は、発熱反応でありながら、UDP-sugarの場合にはUDP、 GDP-sugarの場合はGDPを放出するという、潜在的に、しかもきわめて容易に高いエネルギー(約8 kcal/mol)をさらに引き出しうる系、言い換えれば”エネルギー産生系”としても存在している。とすれば、物質輸送という問題を直接糖ヌクレオチドからの糖転移反応の生成物であるヌクレオシドジリン酸の関与する反応として把握することができるように思われる。すなわち、ひとつの連続した反応過程として”糖鎖延長”=”糖蛋白質移動”として理解しようとするものである。 | ||||||||
| 一般に糖蛋白質の糖の種類は、末端を除きN-アセチルグルコサミン、マンノース、ガラクトースなどによって構成されており、それらの活性化はUDP、GDPによって行われる。いまヌクレオシドジリン酸の末端リン酸結合のエネルギーを使って物質輸送を行う”熱機関”を考えるとき、一応UDP、GDPから放出できるエネルギー=燃料を同じと考えるならば、当然使用されたエネルギー量、言い換えるならば転移された糖の数は仕事量を表し、仕事を輸送とおくならば、その輸送速度を一定とおけば、その仕事量は”輸送距離”に相当する。つまり糖蛋白質の糖含量は、蛋白合成部位から細胞膜まで、あるいは未完成品ながらもそれをプールする膜系までの距離を表しているとみてよいのではないだろうか。 | ||||||||
| 現在我々は細胞外へ分泌されるものが細胞内の限られた一点において合成されているデータも理論的内容も持ち合わせていない。また、たとえ一点で合成されるとしても、細胞自身の運動によってその点から次の膜系までの距離は常に変化していると考えられる。当然のことながら糖蛋白質の構造は、この距離の変動を反映して変化していると考えられる。これが実は我々が観測する糖蛋白質の糖鎖の不揃いの問題なのではないか。 | ||||||||
| このことは村松ら(20)のデータの中で次のように考えられる。細胞が増殖中の時は、大きな運動性をもち(同時によりexpandした構造をもちうるとも考えられる)、その時にはマンノース3モル以上の糖鎖を活発に合成し、contact inhibitionのかかった、あるいは濃度が上がった状態では運動性の減少か、あるいは細胞がよりcompactになり、マンノース3モルの小さなcoreをもつ糖鎖を合成している。つまり、糖鎖の大きさは伸縮可能な膜系の中での距離の問題として考えることができるように思われる。ただここで重要なことは、マンノースが3モル以上のいう伸長したcoreをもつ結果、次の末端にくる糖鎖が不完全になることであり、ここにこのco re部分の大きさがそれだけでは片づかない問題を含んでいると思われる(23, 24)(III章参照)。 | ||||||||
| それではこのような熱機関の存在をどのような事実として示しうるかといえば、わずか2、3のデータしかないのが現実である。それの最もいい例は、Yamazaki, Hayaishiら(25)によってウシ肝臓の小胞体から抽出精製されたチアミンピロホスファターゼのデータである。この酵素はもともとゴルジ体の標識酵素として知られていたものであるが、この研究によってむしろヌクレオシドジリン酸ホスファターゼと呼ばれるのが適当である。それによると、この酵素は一応生理的なものとしてはUDP、GDPを選択的に加水分解する。またFleischerら(26)によれば、この活性は粗面小胞体、滑面小胞体、ゴルジ体に局在し、さらにKuriyama(27)によれば、この酵素は小胞体の内腔に位置していることが報告されている。一般に糖蛋白質にはUDP、GDPによって活性化されている糖しかなく(シアル酸を除く)、糖転移反応によって発生するものと、そこに存在する酵素の特異性が一致することはきわめて興味深い。またこの酵素が小胞体の内側に存在することは、そこで糖蛋白質の合成が行われていることと一致している。これらのデータは何らかの形でUDPやGDPが使われていることを強く示唆しており、糖ヌクレオチド反応の全体性を解く重要な突破口であり、今のところそれを輸送とおいてもそれほどの困難さはないと考えられる。 | ||||||||
|
逆にこのことから推論できるように、チアミンピロホスファターゼとの関係で扱いうる糖鎖の不揃いは、末端部分よりもむしろcore部分の問題であろう。なお、この酵素がコンドロイチン硫酸を活発に合成しているchondrocyteのゴルジ体に多量に存在することはまた示唆的である(28,
29)。 次に、このようにチアミンピロホスファターゼと糖ヌクレオチドとの関係でみたことから出てくる新たな問題について述べてみよう。 |
||||||||
| II−5.XDP-sugarとCMP-sugarの問題(X:U,G,C,A,T) | ||||||||
| このようにみてくるとXDPを生じるようなXDP-sugarは、その反応過程に共有結合生成とともにもうひとつのエネルギー放出性の反応を含んでいる可能性を示している。もちろん、全ての糖ヌクレオチドやヌクレオチドの反応がこのような形で把握できるとは言いがたいが、この方向で解こうと試みることが何故リン酸残基を2モルもつのかとの疑問にアプローチすることであり、いまの場合これを”輸送”(移動)に見立てたわけである。 | ||||||||
| 一方、CMP-NANA(NANAはシアル酸の一種)は何故1モルのリン酸残基しかもたないのか?このことはいままでの展開から行けば、輸送に関与しない反応に関係していると考えられる。ここで思い出していただきたいのは、I-2で述べた内容である。γ-globulinという糖蛋白質の生合成において、シアル酸を転移されたγ-globulinはそれとほとんど同時に細胞外に分泌されることをKern、Swensonのデータ(21)は示している。ここで細胞の内から外への放出過程に2つの考えが可能である。ひとつは、シアル酸結合による物性変化に依存しており、たとえば細胞表面のシアル酸との相互作用によって放出が起こるとする考え方であり、もうひとつは、これとは別にもうひとつ別の反応が共役している可能性である。前者の場合については最近のAshwellら(30, 31)のデータは示唆的である。つまり、intactな血清糖蛋白質を静脈に注入するとかなりの時間血中を循環しているが、一旦シアル酸を除いたもの(たとえ20%位でも)を血中に注入するとたちまち肝臓中に取り込まれてしまう。言い換えるなら、シアル酸のあるなしで膜から出たり入ったりすることを意味し、膜への出入り(表面のみの問題かもしれないが)はそれほどのエネルギーの出し入れがないとも考えられる。このことはシアル酸がCMPというヌクレオチドとして、容易にはエネルギーを引き出し得ないもので活性化されているひとつの積極的な意味が存在しているように見える。しかしKornfeldら(17)のγ-globulinの構造解析によれば、シアル酸を末端にもたない糖鎖が60%も存在することから前者の考えのみで放出過程を理解できないこともまた事実である。ここに最近糖鎖の蛋白質よりについていることが判明したフコース(17, 32)の転移反応(33)が注目を集めるかもしれず、ここに後者の場合の可能性が潜んでいるかもしれない。 | ||||||||
| ここでXDP-sugarとCMP-sugar(CMP-NANA)の関与する反応の様式について少し述べておきたい。いままで述べたように糖蛋白質の生合成の場合、ひとつの糖の転移は次に別のところに位置している酵素の場までその生成物が移動しなければ連続した反応にならないと考えてよいであろう。しかし糖鎖の末端に位置するNANAの場合、次に結合する糖がないことがCMPによる活性化で十分であると考えることができる。そうするとCDP-コリンからのP-コリンの転移によるホスファチジルコリン(その他エタノールアミン、グリセロールも同じこと)の生成はよく理解できる。つまり、P-コリン転移の後に新たな結合を作る反応は存在しないからこそCMPというものを残している。逆に言えばCMPを残し、またそれに共役するエネルギー供給系が備わっていないことがP-コリンの転移による反応終結になっていると考えてよい。それ故にこのようなものの合成は、合成場所がすなわちその生成物の機能の場所でもあり得るであろう。 | ||||||||
| それでは細菌細胞壁のペプチドグリカン生合成(34)の場合を考えてみよう。この場合、糖鎖成長は2つの糖の単位−ムラミン酸ペンタペプチドとアセチルグルコサミン−の重合によって行われるが、この場合膜透過の機構がひとつ介在している。この単位が作られる際には2つの糖ヌクレオチドからの転移で行われるのであるが、ひとつのUDP-ムラミン酸ペンタペプチドの方からはP-ムラミン酸ペンタペプチドという形で特殊なリピドリン酸にリンサンジエステル結合でエネルギーを保存し、もうひとつのUDP-アセチルグルコサミンの方からはUDPを放出してアセチルグルコサミンが転移してリピドに結合した単位を作る。実際の生体内ではこのとき生成するUDPを使ってこの分子が膜を通過し、重合する場合にはリン酸を含まない形で行われ、その反応の連続性はリピドに結合したリン酸残基の分解によって行われるのであろう。たとえば、バシトラシンによるリピドからの1モルのリン酸の分解阻害による糖鎖成長の阻害は、リピドの再生が不可能になることもあるが、これを重合の際の問題ともみられるのではないだろうか。しかしタイコ酸の場合(12)のように”単位”を形成する2つの糖ヌクレオチドのうちのひとつからリン酸残基を生成物の中に取り込む場合には、糖鎖成長の過程に別のエネルギー供給系を考えなければならない。しかしこの場合にも、一般にリピドにあらかじめ結合しているリン酸残基は不安定とも言われていることから(35)、あらかじめリピドキナーゼによってエネルギーを付与されているとも考えられる。リピドリン酸には、ヌクレオチドのα-Pにはみられない特徴があるようである。しかし、2つの糖ヌクレオチドからともにリン酸1モルまでポリマーに取り込んでしまうタイコ酸の場合には、糖ヌクレオチドの持つエネルギーの限界を超えるものとして別のエネルギー供給系を考えなければならないであろう。 | ||||||||
| II−6.未解決の系としての”エネルギー産生系” | ||||||||
| このようにみてくると、糖ヌクレオチドの反応の全体性を解く方向で進めてきた議論は、現在までにすでに解決されてきたと考えられている多くの反応に全く未解決の問題が存在していることを思わせる。たとえば、糖の領域でひとつ例を挙げるなら、糖の活性化段階であるピロホスホリラーゼの問題である。UDP -グルコースを例にとると、どの系でも | ||||||||
| UTP + グルコース-1-リン酸 ・ UDP-グルコース + PPi (inorganic pyrophosphate) | ||||||||
| といわれ、その平衡定数はおおむね1に近い(12)。このときPPi は何の意味をもつのか?いままでよく気楽に言われてきたことは、この反応は平衡反応であることから反応を合成方向に引っ張るためにピロホスファターゼで切られると”説明”されてきた。また、PPi は生体にとって毒性を持つので加水分解されなければならないから、反応を引っ張ることと2つの意味を持つといわれてきた。これらの説明はきわめて目的論的な”説明”にすぎないからこそ、何の実践性ももたらさなかった。 | ||||||||
| またこの説明は次のようなCMP-シアル酸の活性化過程をみれば”説明”としてさえ通用しないことは明らかである。 | ||||||||
| CTP + NANA → CMP-NANA + PPi | ||||||||
| この反応の矢印が合成方向に向いているのは、平衡定数が1000以上であるからであり、いみじくも”合成酵素”と呼ばれているからである(36,37)。つまり、PPi の分解を合成を引っ張るためという必要がないのである。このような、たとえばPPiを生じるような素反応はDNAの合成に始まって無数に存在している。PPiの分解がATPの分解と同等のエネルギーの放出(7〜8 kcal/mol)を伴うことを考えるなら、何らかの問題意識、たとえば場所の移動とかでアプローチしないならば決して解くことのできない反応でもある。 | ||||||||
|
さらにこの2つの例の中で重要なことは、UDP-グルコースの合成系の平衡定数はほぼ1に近く、そして、UDP-グルコースのリン酸−グルコース結合は7〜8kcalの加水分解エネルギーを放出するのに対して、CMP-NANAの場合には平衡定数が1000倍以上ということからかなりのエネルギーが、たとえば3kcal程度がUDP-グルコースの場合に比べて失われてしまっていると考えるのは普通であろう。もしそうだとしたら、一般にNANAの糖蛋白質における結合様式が酸に弱いことを考慮に入れると、まったくの推測だが、CMP-NANAとNANA-糖蛋白質の間にはそれほどのエネルギー落差がなく、ある意味では、不可逆過程とみられている普通の糖ヌクレオチドからの糖の転移反応とは異なり、より可逆性を持った反応として存在しているのではないかとも考えられる。したがってこの反応は、別のことばで言えば、ある種の感知器を意味し、この反応が細胞表面で行われていることによって、細胞自身が細胞濃度、環境を感知しているとも考えられる。 ある意味でこのような内容をシアル酸関連の転移反応に付与できるという意味において、”エネルギー産生系”の内容を把握することはきわめて重要である。 |
||||||||
| II−7.このような統一的把握の限界性 | ||||||||
|
以上述べてきたように、糖ヌクレオチドからの糖転移反応はさらに熱機関によるヌクレオシドジリン酸の利用系をも含む可能性のあることを糖蛋白質構造の多様性の中で追求してきたわけであるが、これらはなお大きな限界を抱えている。 第一に糖蛋白質の構造のheterogeneityを”糖含量”という言葉でしか表現しなかったが、たとえばα1-酸性糖蛋白質は9本以上の糖鎖が1本の蛋白質に結合しているといわれていることから、なぜ1本の糖鎖として表現されず、何本もの糖鎖に分かれているのかとの問いには全く答えることができない。それはたぶん、細胞外に分泌されたときの意味との関連する問題であろう。ただひとつ言えることは、エネルギーの量子収率の問題が生合成の側面から答えをひとつ出せる可能性があるということである。つまり、所詮輸送は、どのような熱機関であれ、最終的には輸送される分子の運動エネルギーに転化されるはずであり、それには1本の糖鎖を作る形で連続的な反応を遂行するよりは、その何倍かの糖鎖に同時に多くの糖を転移することによってエネルギーの損失を少なくできるはずである。もしそうだとすれば、合成途上の分子では、何本もの糖鎖を同時に合成しているのであろう。 |
||||||||
| このエネルギーの効率的使用ということに関して、図2は糖含量の最も少ない糖蛋白質部分が全体のα1−酸性糖蛋白質の中で最も多量に存在することを示しており(ボルツマン分布ではなく)、細胞外での糖蛋白質の役割を糖含量のある範囲内でヘ同じと仮定すると、このデータはよく理解できる。しかしながらAshwellらのデータにみられるごとく、糖部分が、たとえば血液中での挙動を完全に支配していることを考えると、このような糖に対する甘い考えは許されそうもなく、また糖の種類の違いの持つ意味を含めて細胞外での糖の意味について徹底的な考察が必要である。 | ||||||||
| 第3の問題点は、糖鎖のHeterogeneityにたいして距離、蛋白合成場所から膜までの距離という概念を適用したが、血清糖蛋白質にもα1−酸性糖蛋白質のように40%もの糖含量をもつものから10数%の糖含量をもつものまで多種多様存在することから、糖含量の構造への影響、つまり生理的意義の他に、代謝回転速度の問題としても考えねばならないであろう。というより、前述したごとく、量子収率の問題はひいては輸送速度、言い換えれば合成速度の問題であり、速やかな代謝回転速度を持つものを、速やかに合成するという意味で、距離の問題を速度の問題として置き換えうるものである。もちろん、我々にとって多種多様の血清糖蛋白質が同一の速度で代謝回転しているとは直感的にも考えにくい。でも、ここで”距離”を”速度”と読み変えても、糖ヌクレオチド反応の全体性の中に熱機関を想定することに何の矛盾も存在しない。 | ||||||||
| 第4の問題点としては、この熱機関については現在全くBlack Boxであるが、最近とくに興味を集めているmicrotubular proteinという運動性蛋白質は細胞内諸器官に存在していることから、これを含んだ系の中で解決される可能性もある。 | ||||||||
| 第5の問題点は、この熱機関の直接のエネルギーをUDP、GDPのようなジリン酸とおいたことである。確かにこのことは分解酵素の特異性をきわめて容易に理解することはできるが、一方このようなリン酸化合物は膜透過はできないと言うのが通説になっており、糖ヌクレオチドを合成場所である小胞体膜内へ以下に運ぶかとの問題を考えておかなくてはいけない。このことは、糖ヌクレオチドの合成途上で生じるPPiの分解のエネルギーということで理解してもよいが、一方ではStromingerら(38)のように、リピド中間体にP -sugarという形でふかしてエネルギーを保存しつつ、Lipid-P-O-P-sugarという形で膜透過と糖転移を行い、残ったLipid-P-O-Pを直接のエネルギー源としたり(この場合、分解酵素がこのようなものにアタックできるかどうかは不明)、または、膜内にcompartmentされたヌクレオシドジリン酸が存在し、sugar-1-Pのみを外から内へ移動させ、結果的には小胞体内で同じかたちのXDP-sugarを用いることなどさまざまな形態が可能である。これらのことについては、現在の我々の熱機関のアイディアから直接いえることは何もない。 | ||||||||
| 第6の問題点としては、当然のことではあるが、リン酸2モルの問題をはじめとして、塩基の種類の問題は、糖ヌクレオチドが糖部分の構造変換に関与していることもあって別の問題を含んでいるはずであり、熱機関の問題の中で糖ヌクレオチドの”全体性”を把握できるはずがないことは承知していなくてはならないであろう。 | ||||||||
|
第7の問題は、実は最も大きいところであるが、それは糖蛋白質の移動に際して、はたして8
kcalものエネルギーが必要なのかどうかということである。もちろん、我々としては糖蛋白質を一定の場所(たとえば次の酵素の位置)にorganizeするということは高いエネルギー要求性があるのではないかと考えているが、正直なところ分からない。ただ、よく知られているように、リボゾーム上での蛋白合成においてひとつの共有結合の形成に際してなぜか2モルのGTPがエネルギー源のような形で使われているらしいことを対置する以外にはないのである。もし、UDPがいままで述べてきたような使われ方ではない場合、それでは一体何なのであろうか。(1972年12月) (なお、以下の試案はタイトルからみればいかにも糖関連のことのみのように見えるかもしれないが、実はそれ以外の内容も多数含んでいるので、できるだけお読みいただければ幸いである。) |
||||||||
|
III.細胞外物質の多様性と相互作用の連続性 (上のタイトルをクリックすればリンク) |
||||||||